非破壊・非接触酸素濃度計(1チャンネル式) OXY-1 SMA/SMA trace

非破壊・非接触酸素濃度計(1チャンネル式)
OXY-1 SMA/SMA trace
PreSens社製 OXY-1 SMA traceは密閉空間内の酸素濃度を外部から非破壊的に測定できるセンサー用の1ch 高感度酸素計です。
密閉容器内の酸素測定(PETボトル、パウチ等、PTP包材等)や、細胞培養時の酸素測定による活性モニタリングなどを屋内外問わず、簡単・迅速に実施できます。
1ppb, 0.002%の酸素まで測定可能な高感度センサーと15ppb,0.03%まで測定可能な通常感度センサーの2種類のセンサーを使用できます。
OXY-1 SMAは標準感度対応、OXY-1 SMA traceは標準感度及び高感度対応です。







- 概要
概要
長年多くのお客様にご利用いただいている、Fibox 3 trace の後継機種です。電源供給及びPCとの通信はUSBとなり、非常に小型でコンパクトになりました。PC ソフトウェアでは、センサーを複数登録でき、校正データも各センサー毎に紐付されます。
高感度センサー(別売)の種類には非破壊測定に用いますセンサーチップの他、プローブ式、フローセル式などごがあり、用途に合わせて選べます。
通常感度センサーも使用できます。本体は小さく、低消費電力で、堅牢なケースで覆われているため、屋内屋外問わず簡単にご使用できます。
測定原理
PreSens 社酸素計はファイバーの先端に酸素に感度を持つ蛍光染料(酸素センサー)をコートし、そこから発せられ る蛍光エネルギを測定するという光学的手法を利用しています。酸素センサーから放たれる蛍光エネルギは周囲の酸素により抑制されるので蛍光の強度と寿命を 測定することにより測定部位の酸素量を知ることができます。
使用事例
密閉容器内の酸素測定(PETボトル、パウチ等、PTP包材等)
細胞培養時の酸素測定による活性モニタリング
微生物培養時の酸素測定による活性モニタリング
使用可能な酸素センサー
高感度酸素センサーチップ PEベース(オートクレーブ不可)とガラスベース(オートクレーブ可)があります。
※通常感度のセンサーもご使用頂けます。
関連ページ
特徴
5mm程度の円形のセンサーチップを容器内部に貼付し、外部からファイバーケーブルを通して光の照射、蛍光の捕集を行うことで密閉容器内の酸素測定を可能にしています。また、1つのセンサーにて気相液相の両方が測定可能です。測定範囲は気体で0-5%(検出下限0.002%)、液体で0-2ppm(検出下限1ppb)となっています。また、反応応答性が速く、最小測定間隔は3秒(通常感度センサーの場合1秒)となっています。
操作・測定にはPCが必要で、付属のソフトウェアをインストールの上、ご使用頂きます。
- 非破壊・非接触酸素測定。
- キャリブレーション・フリー
- クイック・レスポンスロー・コスト(測定試薬等はありません。)
- 炭酸ガス等の干渉はありません。取扱いが極めて容易。
- 気体・液体サンプル測定可能。
- 酸素電極のような酸素消費測定ではありません。
- 流動性がなく粘度の高いサンプルでも使用可能。
- バッファーを使用せず、サンプルへの余計な液体の流出がありません。
測定原理
PreSens社非破壊酸素計はセンサースポットと呼ばれる酸素に感度を持つ蛍光染料フィルム(酸素センサー)から発せられる蛍光エネルギを測定するという光学的手法を利用しています。測定前にパッケージ内面に取り付けたセンサースポットに外部から光を照射します。
それによりセンサースポットから放たれる蛍光エネルギは周囲の酸素により抑制されるので、蛍光の強度と寿命を測定することによりパッケージ内の酸素量を知ることができます。
アクセサリ
以下のアクセサリにより様々アプリケーションに対応可能です。
プローブ酸素センサー
- 浸漬・プロセス用途
- H2O2、EtOH耐性
- 堅ろう性
- 長期安定性
フローセル用酸素センサー
- オンラインモニタ用途
- H2O2、EtOH耐性
- 堅ろう性、長期安定性
- 長期安定性
非破壊測定用酸素センサー
- 非破壊、非接触測定用途
- オンラインモニタ用途
- 滅菌可能(130℃1.5atm)
- H2O2、EtOH耐性
※通常感度のセンサーもご使用頂けます。
※お客様のアプケーションに対応したカスタマイズも可能です。
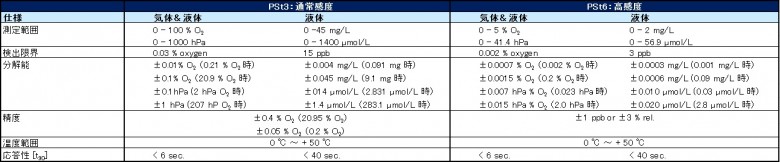
仕様
仕様一覧(画像クリックで拡大)
導入事例
最も正確な酸素測定のためのオートクレーブ可能なセンサー 非接触酸素センサーSP-PSt3-YAU

バイオプロセス開発:振とうフラスコ中の酸素モニタリング
O2供給は、好気性生物の栽培における主要な問題の1つです。
シェイク(振とう)フラスコ培養は、学術および産業バイオプロセス開発に広く適用されています。
溶存酸素の実際のモニタリングのための適切な方法が欠落しているので、通常、十分なO2供給がなされていると仮定されています。
振とうフラスコ内の非侵襲性・非破壊酸素センサーは、酸素供給を確保し、代謝活動についての正しく新しい洞察を与えてくれます。

呼吸と光合成:ガラスバイアルの酸素モニタリング
呼吸活性の測定は、無脊椎動物、幼虫期または卵などの水生生物だけでなく、
細菌、細胞培養物、酵母または真菌についても行われることが多い研究対象です。
藻類については、光合成活性の測定が非常に重要です。
一体化されたセンサーストライプを備えた 20 mL SensorVial を使用して、液体サンプルの溶存酸素とヘッドスペースの酸素ガスを
同時に測定することができます。
攪拌および非攪拌用途のオートクレーブ可能なセンサーバイアルが利用可能です。

灌流システムにおけるオンライン酸素モニタリング フロースルーセル式酸素センサーFTC-PSt3
フロースルーセル式酸素センサー(FTC-PSt3)に組み込まれた小型化された化学的光酸素センサーは、
潅流システムにおける酸素の非侵襲的オンライン監視を可能にします。
センサーは色分けされたスティックに固定されており、必要に応じてサイズと形状の異なるフロースルーセルに取り付けることができます。
ポリマー光ファイバで、フロースルーセル内のセンサをそれぞれのO2メータ(例えば、OXY-1 SMA)に接続します。
FTC-PST3セルはポリカーボネート製です。

灌流システムにおけるオンライン測定
ベータ照射および事前校正されたpHおよびDOフロースルーセンサーは、
灌流システムに統合することができます。
これにより、灌流リアクタのプロセスパラメータを簡単に制御できます。
典型的にはルアーコネクタが使用されますが、流量の大きさに応じて異なるサイズが利用可能です。
3D細胞培養におけるインライン酸素モニタリング
酸素は培養培地中で低い溶解度を有するので、培地の一定の灌流によって3D足場内の細胞に酸素が供給されなければならない。
細胞が通過した前後の培地中の酸素含有量測定は、適用される流速が十分であるかどうかを判断するのに役立ちます。
統合された化学的光学センサを備えたPreSensフロースルーセル酸素センサーは、コンストラクションの入口および出口に組み込まれ、
酸素張力のインライン測定を可能にします。
オンライン酸素モニタリングのための堅牢プローブプローブ式酸素センサーDP-PSt3
通常酸素範囲での測定のためのプローブ式酸素センサーDP-PSt3は、一端が酸素感受性箔で被覆されたポリマー光ファイバで構成されています。
ファイバの端部は、センサ材料とファイバの両方を保護するために高品位の鋼管で覆われています。
鋼管の外径は4mm、長さは10cmです。他の長さもご要望に応じてご利用いただけます。
ポリマー光ファイバーの使用により、このプローブは+ 70℃までの温度に適合します。
- 優れた長期安定性
- 耐圧(最大5 bar)
- 偏光を含まない
- メンブレンクリーニングと交換が不要
- 補充する電解液がない
- 長い貯蔵寿命

土壌における長期測定
PreSens社は酸素を消費しない酸素測定のためのプローブ式酸素センサーを提供しています。
それらの小さな寸法のために、それらは流れおよび物質輸送を妨害せず、
その結果その場の酸素濃度を表示します。PreSens社のミニセンサーは長期的に安定しているので、
長年にわたって土壌に埋め込むことができます!
この新しい方法により、植物の生産性にとって非常に重要な土壌曝気のプロセスを調査することができます。
Heidi Heuberger博士、ミュンヘン工科大学、ミュンヘン、ドイツ

環境調査:土壌フィルターの調査
小さな外形寸法と機械的堅牢性のために、プローブ式酸素センサーは、下水の流れの間にフィルターサンドを充填したカラム内の酸素含有量を
その場で測定する可能性を提供します。(画像参照)。
測定結果は、酸素不足が硝化プロセスを停止させることを示唆していました。

低濃度サンプルへ高感度酸素測定を 高感度酸素センサーSP-PSt6-NAU
センサスポットは、非侵襲・非接触式光酸素センサの最も汎用性のあるバージョンです。
例えば、包装材に使用されるような透明なガラスまたはプラスチック容器の内面に取り付けることができます。
酸素は透明な容器壁を通して非接触で測定されます。SP-PSt6-NAUは、0〜5%の溶存又は気相の測定範囲を有しています。
酸素感受性コーティングは、125μmの透明ポリエステル膜上に固定されています。
・非侵襲・非破壊測定
・酸素の消費がない
・流速に依存しない安定測定
・液体中および気相中双方の酸素を測定可能

PETボトルの酸素透過率測定
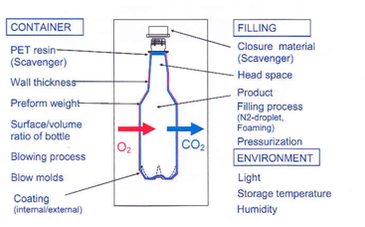
貯蔵寿命に影響を及ぼす要因
PETの分子構造が酸素侵入およびCO2の損失に対する不十分なガスバリア性を有していない場合、
PETボトルの飲料の貯蔵寿命およびフレーバー品質を低下させる化学プロセスを引き起こします。
したがって、PETボトル(材料、シール、クロージャーなど)のガスバリア性は飲料の消費期限において非常に重要です。
いくつかのボトルはほぼ完全な密封性を備えていなければならず、他のボトルは選択的なガス透過性でなければならない場合があります。
そして、貯蔵寿命に影響を与える要因は様々です。
それ故、正確な透過速度に関する知識は不可欠です。
現在の測定方法
PETボトルの酸素進入を測定する一般的な2つの方法があります。
まず、試験フィルムで分離された中央モジュールを使用する電気化学測定プロセス。
第二に、間欠的な接触による測定。
その後、約15年前に第3の方法がPreSens社により確立されました。
光学化学センサ技術を使用した非侵襲的測定で、PETボトル内の微量の酸素濃度を検出することで酸素透過率を測定できます。
PETボトルは破壊する必要なく、同じボトルで任意の数の測定を行うことができます。
これは、気相(ヘッドスペース)だけでなく、飲料の溶存酸素自体にも可能であり、工業用途において大きな利点があります。
検出原理はクエンチングという技術と蛍光消光法(蛍光遅延法)に基づいているルミネッセンス減衰時間を測定します。
この目的のために、光ファイバが光をセンサに照射・励起し、蛍光信号を酸素透過測定装置に組み込まれたフォトダイオードに戻します。
この測定技術により、少量のサンプルと信頼性の高いデータで長期間の研究が可能になります。
気体または溶存酸素の濃度レベルは、1ppbと高分解能で検出できます。
異なるボトルタイプの結果
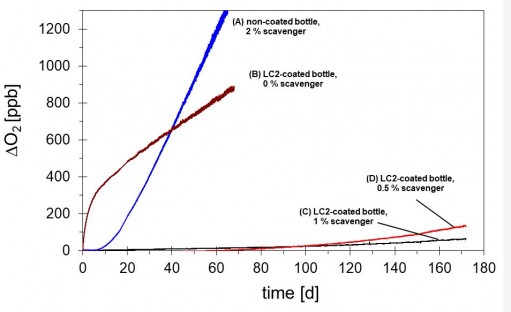
下の図は、異なる処理を施したPETボトルにおける酸素透過度の測定値を示します。
外部バリアコーティングおよび異なる量の脱酸素剤物質の包含量に依存します。
これらスカベンジャーは、ボトル材料自体に含まれる酸素が製品に移動するのを防止する機能があります。
(A)2%スカベンジャーを有するコーティングされていないPETボトル
(B)スカベンジャーを含まないLC2被覆PETボトル
(C)LC2被覆PETボトル(1%スカベンジャー)
(D)0.5%捕捉剤を含むLC2被覆PETボトル
組み合わせシステム(C)および(D)は、活性(スカベンジャー(A))またはパッシブ(LC2コーティング(B))バリアのみで6ヶ月にわたって酸素浸入を1ppm未満に維持する達成することができました。
製品に侵入するる酸素量がコーティングの位置(外部または埋め込まれた)および酸素スカベンジャーの使用の有無に依存することを示しています。
最高の性能は、スカベンジャーと大気中の酸素との反応を防止するための保護層としても働くパッシブバリアーに加えて、アクティブバリアー(スカベンジャー)を使用するボトルによって示されました。
このようにして、スカベンジャーの量が減少しても180日以上の貯蔵寿命に達することができました。
これらの測定には非接触高感度酸素センサーSP-PSt6が最適なソリューションです。
製薬メーカー
- バイアル・ブリスター・アンプル内のヘッドスペースの酸素, 液体薬剤・注射剤の溶存酸素
- 包材, 包装剤, 機能性フィルムの 酸素透過性(バリア性)の評価、窒素ガス充填度合の確認
- 脱酸素剤の評価
食品・フィルムメーカー
- 包材, 包装剤, 機能性フィルムの 酸素透過性(バリア性)の検討評価、窒素ガス充填度合の確認
- 品質保証期限の延長検査
- 脱酸素剤の評価
バイオ・再生医療
- 動物細胞のディッシュ, シャーレ内の培養液のモニタリング
- バイアル瓶内での密閉培養時の酸素モニタリング
関連情報 Related information
| 展示会・ セミナー |
|
|---|---|
| 関連製品 |
|